
硫黄の化学式は?S₈なのはなぜ?
硫黄の化学式は S₈

硫黄の元素記号はSですが、硫黄の化学式は S₈ です。
単体の硫黄は通常、一原子の状態(単原子形態の硫黄)では存在しません。自然界や実験室の通常の条件下では、硫黄は多員環分子として存在します。最も一般的な形態はS₈、すなわち八員環の硫黄です。
しかし、非常に特定の条件下、たとえば高温のガスフェーズや特定のプラズマ状態では、S(単原子の硫黄)が一時的に存在することが知られています。しかし、この単原子形態は非常に反応性が高く、短時間で他の形態の硫黄や他の化合物と反応する傾向があります。
要するに、通常の条件下で硫黄が単原子の形態で安定して存在することはほとんどなく、多員環形態が主要な存在形態となります。
そのため、硫黄の化学式は自然界で最も一般的に見られる硫黄の形態である、八員環の硫黄= S₈ となります。
S₈ 八硫黄とは
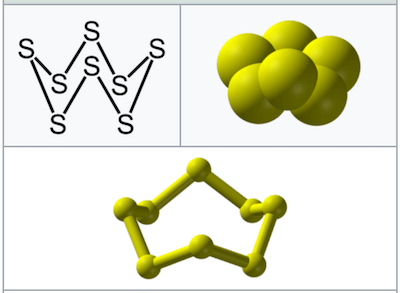
S₈は八硫黄(Octasulfur)またはオクタチオカン(octathiocane)と呼ばれます。
八硫黄は、8つの硫黄原子が環状に結合している構造を持っています。この環状構造は、自然界で最も安定で一般的に見られる硫黄の形態です。八員環の硫黄の構造は、ほぼ正八角形に近い形をしています。
この八員環の硫黄は、通常、黄色くて結晶構造を持つ固体として存在します。硫黄は加熱すると融解し、さらに加熱を続けると多様な多員環や線状の構造を持つ硫黄分子へと変化します。しかし、冷却されると再びS₈の環状構造に戻ります。
自然界での硫黄の堆積や火山ガスからの硫黄の析出は、このS₈の形態でよく見られます。
硫黄がS₈になるのはなぜ?理由は?
硫黄がS₈の形態をとる理由は、エネルギー的な安定性に基づきます。以下は、S₈の存在に関連する主な要因をいくつか挙げています。
- 結合エネルギー: 一般的に、分子がエネルギー的に安定な形態を採用するのは、全体としてのエネルギーを最小化するためです。S₈は他の硫黄の多員環分子(例えば、S₆やS₇)に比べて低いポテンシャルエネルギーを持ち、したがって熱力学的にはより安定しています。
- 立体的な問題: S₈の正八角形の構造は、立体的にも最もバランスが取れた形態を持っています。これは、原子間の斥力を最小化し、結合を最適化するためです。
- 歴史的な背景: 硫黄は長い間、S₈の形態で存在してきました。したがって、この形態は地球上での硫黄の歴史やその生成過程の結果として得られるものである可能性があります。
- 環状構造の強度: 硫黄原子同士の結合は強固であり、S₈の形態では各硫黄原子が2つの隣接する硫黄原子と結合しているため、全体としての強度が高まります。
これらの要因の組み合わせが、硫黄がS₈の形態をとる主な理由となっています。
硫黄 S₈ はどこにどのように存在する?

S₈(八員環の硫黄)は、自然界のいくつかの場所に様々な形で存在します。以下に主な存在場所と形態を示します。
- 地下の硫黄鉱床: 大部分の硫黄は、地下の硫黄鉱床として存在します。これらの鉱床は、地下深くに埋蔵された硫黄を含む鉱石や岩石から採掘されます。採掘された硫黄は、黄色くて結晶状の固体として存在します。
- 火山: 火山活動の際に放出されるガスには、硫黄が含まれていることが多いです。この硫黄は、火山ガスが冷却されることで、黄色い結晶や粉状の硫黄として析出します。火山の近くには、このようにして形成された硫黄の堆積物が見られることがあります。
- 硫黄泉: 一部の温泉は、硫黄分を含むことで知られています。これらの硫黄泉から上がるガスや湯の中に、微量の硫黄が含まれていることがあります。
- 石油精製: 石油の精製過程で、硫黄化合物が分離されることがあります。これらの化合物から硫黄を回収すると、黄色の結晶状の硫黄が得られます。
これらの場所や状況での硫黄は、主にS₈の形態で存在しますが、温度や圧力の変動によって、他の形態へと変化することもあります。
硫黄のS₈以外の形態は?
以下は、温度や圧力の変動による硫黄の形態変化に関する具体的な情報です。
- 融解: 硫黄を約115°Cに加熱すると、黄色透明な液体に融解します。この時、S₈の八員環構造が保持されています。
- 再結晶: 159°C以上でさらに加熱すると、硫黄は黄橙色の粘性のある液体となり、多員環や線状の構造をとるようになります。この粘性の液体は、線状のS₂、S₃、S₄などの形態が多く含まれると考えられています。
- 再固化: この粘性の硫黄を急速に冷却すると、アモルファス(非結晶質)な硫黄が生成されることがあります。この形態の硫黄はゴム状の性質を示します。
- 高温での気化: 硫黄をさらに加熱すると、約444.6°Cで沸騰し、気化します。気化した硫黄は主にS₂の形態として存在します。
- 高圧下: 圧力の変動も硫黄の構造に影響を与えることが知られています。特に高圧下では、硫黄の多員環の構造が変化し、異なる結晶構造を示すことが報告されています。
以上のように、温度や圧力の変動によって硫黄の分子構造や物理的性質は大きく変わります。
二硫黄S₂はどんな硫黄?
S₂は硫黄分子の一つで、二つの硫黄原子が直線状に結合した形態をしています。
以下に、S₂に関する特徴や情報をいくつか示します:
- 形態: S₂は線状の分子であり、二つの硫黄原子が単結合で直接結合しています。
- 存在状態: 硫黄が高温で気化するときに、S₂が主な気相の形態として存在します。この形態は、特に硫黄が沸騰する温度(約444.6°C)付近で一般的です。
- 色: S₂は淡紅色を呈することが知られています。この色は、S₈の黄色とは異なります。
- 生成: S₂は硫黄の蒸気を急速に冷却することで得られることもあり、このとき得られる赤褐色の硫黄の沈殿はS₂が結晶化したものと考えられています。
- エネルギー: S₂はエネルギー的にはS₈よりも不安定であり、通常の条件下では長く存在することは難しい。しかし、高温や特定の条件下では生成や存在が確認されます。
- 吸収スペクトル: S₂の特徴的な淡紅色は、特定の波長の光を吸収することに起因しています。この特定の波長の光の吸収は、S₂の電子遷移に関連しています。
S₂は、硫黄の気相中に一時的に存在する形態として興味深いものですが、常温や常圧の条件下では安定して存在するわけではありません。
三硫黄S₃はどんな硫黄?
S₃は三つの硫黄原子からなる硫黄分子で、環状の構造を取ります。以下は、S₃に関する主な特徴です。
- 形態: S₃は三員環構造を持つ硫黄分子です。つまり、三つの硫黄原子が環状に結合しています。
- 色: S₃は淡青色を呈することが知られています。これはS₂の淡紅色やS₈の黄色とは異なる色調です。
- 存在状態: S₃は一般的な条件下では安定して存在するわけではありません。高温や特定の反応条件下で一時的に形成されることがあります。特に、高温での硫黄蒸気中や硫黄の部分的な酸化などの反応中に生成されることが知られています。
- エネルギー: S₃はエネルギー的にはS₈よりも不安定です。しかし、その存在は一部の化学的環境下で確認され、特にスペクトロスコピーなどの手法でその特性が研究されています。
- 吸収スペクトル: S₃の特有の色は、特定の波長の光を吸収することに関連しています。この光の吸収はS₃の電子遷移に起因しており、この性質を利用してS₃の存在や特性を研究することができます。
S₃は硫黄の多員環分子の中の一つで、その独特な色や形態は硫黄の多様な化学的性質を示す興味深い例となっています。
四硫黄S₄はどんな硫黄?
S₄は四つの硫黄原子からなる硫黄分子で、四員環の構造を持っています。以下は、S₄に関する主な特徴や情報を示します。
- 形態: S₄は四員環構造を持つ硫黄分子です。これは、四つの硫黄原子が環状に結合している構造を意味します。
- 存在状態: S₄は通常の条件下では安定して存在しない非常に反応性の高い形態の硫黄です。特定の反応条件下や高温の硫黄蒸気中で一時的に形成されることがあります。
- エネルギー: S₄はエネルギー的にはS₈よりも不安定です。このため、特定の反応条件下でのみ短時間存在すると考えられます。
- 生成: 特定の反応条件、特に高温下の硫黄の蒸気や部分酸化の条件下で、一時的にS₄が形成されることが知られています。
- 利用: その特有の反応性や形態に関する知識は、硫黄の化学や物理的性質の研究で利用されています。
S₄は硫黄の複数の多員環形態の中の一つであり、その高い反応性や短命な存在が特徴的です。
まとめ:硫黄の化学式は?S₈なのはなぜ?
最後に、この記事のポイントをまとめます。
- 硫黄の化学式はSだが、自然に最も安定して存在するS₈が一般的である。
- 硫黄は単体の原子の状態では自然には存在しない。
- S₈の形態が、エネルギー的な安定性が最も高いからである。
- S₈以外には、S₂、S₃、S₄も存在する。
以上です。